蛋白提取及WB: Difference between revisions
No edit summary |
No edit summary |
||
| Line 8: | Line 8: | ||
#移液枪转移12孔板中cell培养液到ep管中,底部留存部分液态培养基; | #移液枪转移12孔板中cell培养液到ep管中,底部留存部分液态培养基; | ||
#胰酶或者细胞刮板分离底部粘璧cell,移液枪转移至上述ep管中。流式不可采用刮板,会损伤cell;刮板用PBS清洗; | #胰酶或者细胞刮板分离底部粘璧cell,移液枪转移至上述ep管中。流式不可采用刮板,会损伤cell;刮板用PBS清洗; | ||
#离心2k rpm 3min,弃去上清,PBS重悬,n合1,再次离心,弃上清,清洗cell | #离心2k rpm 3min,弃去上清,PBS重悬,n合1,再次离心,弃上清,清洗cell | ||
#按照12孔板每孔cell加入25 | #配制细胞裂解液:配制100 mM的PMSF in IPA,临用前用商品化的细胞裂解液稀释100倍。 | ||
#按照12孔板每孔cell加入25 ul细胞裂解液的比例向ep管加入cell裂解液,4 ℃裂解10-30min、14k rpm离心15min。(6孔板每孔50ul裂解液) | |||
#可取部分上清用于BCA测定 | |||
#用上清稀释loading buffer(按照loading buffer 的要求),金属浴or沸水浴 5 - 10min,防止ep管加热过程开盖 | #用上清稀释loading buffer(按照loading buffer 的要求),金属浴or沸水浴 5 - 10min,防止ep管加热过程开盖 | ||
#-40--80℃保存,防止降解 | #分装,-40--80℃保存,防止降解 | ||
==SDS-PAGE== | ==SDS-PAGE== | ||
===制胶=== | ===制胶=== | ||
| Line 38: | Line 40: | ||
</tr> | </tr> | ||
</table> | </table> | ||
<li> | <li>根据目标蛋白的分子量,按照制胶试剂说明书调配试剂,制作分离胶和浓缩胶,倒入玻璃板,分离胶灌至距绿边1cm,浓缩胶灌满,插入梳子。[[File:SDS-PAGE凝胶比例.jpg|center|thumb|300px|SDS-PAGE凝胶比例]] | ||
<li>凝固后,将玻璃板转移至电泳槽中,薄板向里,向夹层中倒入电泳液,验漏(是否夹紧,否则电泳时功率不稳) | <li>凝固后,将玻璃板转移至电泳槽中,薄板向里,向夹层中倒入电泳液,验漏(是否夹紧,否则电泳时功率不稳) | ||
<li> | <li>拔出梳子,吸取电泳液清洗样品孔,排气泡以及排除残余胶液 | ||
<li> | <li>配制Loading buffer上样缓冲液 | ||
<li> | <table class="wikitable" style="margin: auto; border-collapse: collapse; border: 1px solid #a2a9b1;"> | ||
<tr> | |||
<th colspan="2">上样缓冲液组成</th> | |||
</tr> | |||
<tr> | |||
<th>Reagent</th> | |||
<th>Quantity </th> | |||
</tr> | |||
<tr style="border-top: 1px solid #a2a9b1;"> | |||
<td>Tris</td> | |||
<td>3.8 g</td> | |||
</tr> | |||
<tr> | |||
<td>10%SDS</td> | |||
<td>10 mL</td> | |||
</tr> | |||
<tr> | |||
<td>甘油</td> | |||
<td>10 mL</td> | |||
</tr> | |||
<tr> | |||
<td>溴酚蓝</td> | |||
<td>0.05 g</td> | |||
</tr> | |||
<tr> | |||
<td>UP水</td> | |||
<td>100 mL</td> | |||
</tr> | |||
<tr> | |||
<td>巯基乙醇</td> | |||
<td>临用前加入,巯基乙醇:与前述溶液按照=1:3混合</td> | |||
</tr> | |||
</table> | |||
<li>上样及marker,一般1孔20ug,最多30ul;最侧边的孔及空余孔上样 1xloading buffer(电泳液稀释) | |||
<li>电泳电压:浓缩胶约90V(W约为4W),分离胶约150V(W约为8W),室温 | |||
<li>溴酚蓝迁移至凝胶2/3处即可停止电泳[[File:SDS-PAGE电泳例图.jpg|center|thumb|300px|SDS-PAGE电泳例图]] | <li>溴酚蓝迁移至凝胶2/3处即可停止电泳[[File:SDS-PAGE电泳例图.jpg|center|thumb|300px|SDS-PAGE电泳例图]] | ||
</ol> | </ol> | ||
| Line 76: | Line 113: | ||
</tr> | </tr> | ||
</table> | </table> | ||
<li> | <li>PVDF膜及其支撑膜浸入乙醇中活化5 min;转入转膜缓冲液浸泡5 min;膜右上角剪口分辨方向 | ||
<li>转膜缓冲液倒入盘中,各层预先在盘中浸透 | <li>转膜缓冲液倒入盘中,各层预先在盘中浸透 | ||
<li> | <li>黑色在下,按照2层海绵-3层滤纸-gel(切割周围)-3层滤纸-2层海绵,进行叠加,注意排出气泡,夹紧,按照标识放入电泳槽 | ||
<li> | <li>4 ℃冰水浴,300 mAh,电泳约50 min | ||
</ol> | </ol> | ||
| Line 87: | Line 124: | ||
[[File:WB实验.jpg|center|thumb|300px|WB实验]] | [[File:WB实验.jpg|center|thumb|300px|WB实验]] | ||
<ol> | <ol> | ||
<li> | <li>剪裁目标蛋白和参比蛋白的膜,浸入封闭液中,摇床15min(按封闭剂的种类) | ||
<li>TBST配制: | <li>TBST配制: | ||
<table class="wikitable" style="margin: auto; border-collapse: collapse; border: 1px solid #a2a9b1;"> | <table class="wikitable" style="margin: auto; border-collapse: collapse; border: 1px solid #a2a9b1;"> | ||
| Line 120: | Line 157: | ||
</tr> | </tr> | ||
</table> | </table> | ||
<li>弃封闭液 | <li>弃封闭液,TBST清洗5次(摇床5 min) | ||
回收一抗,膜用TBST清洗5次,每次摇床5min后弃去,去除残余一抗 | <li>加一抗5ml(用3%脱脂奶粉稀释),膜浸透,避免漂浮或粘壁,37度摇床1h,4℃过夜 | ||
<li> | <li>回收一抗,膜用TBST清洗5次,每次摇床5min后弃去,去除残余一抗 | ||
<li>使用314的BioRad凝胶成像系统,image | <li>加入二抗(用3%脱脂奶粉稀释),37度摇床1h,TBST清洗5次,最后将膜保存在TBST中 | ||
<li>使用314的BioRad凝胶成像系统,image lab软件,将缓冲液中保存的膜浸泡至显影液(按说明书配制)中2min,转移至培养皿,放入样品盘,成像 | |||
<li>仪器: | |||
<ol> | |||
<li>开机:插排-稳压电源-仪器-电脑(关机反方向) | |||
<li>image lab软件:运行软件-确定-select scanner-chom...-select-chem Hi sentilye(取消VVA勾选) | |||
[[File:WB结果例图.png|center|thumb|300px|WB结果例图]] | [[File:WB结果例图.png|center|thumb|300px|WB结果例图]] | ||
| Line 129: | Line 171: | ||
==备注== | ==备注== | ||
#实验操作: | #实验操作: | ||
##制胶前用70% | ##制胶前用70%乙醇清洁并擦拭玻璃板,提前洗净烘干。 | ||
##内参一般不和样品同一块膜,单染方便抗体回收,只回收一抗,不回收二抗。一抗多为兔种属,二抗是抗兔的山羊抗,二抗基本只针对一抗的种属。抗体一般-20℃保存。 | ##内参一般不和样品同一块膜,单染方便抗体回收,只回收一抗,不回收二抗。一抗多为兔种属,二抗是抗兔的山羊抗,二抗基本只针对一抗的种属。抗体一般-20℃保存。 | ||
##制好的胶尽快使用,不隔夜 | ##制好的胶尽快使用,不隔夜 | ||
##上层溶液左中右位点均匀加入 | ##上层溶液左中右位点均匀加入 | ||
##该测定实验本身影响因素较多,所以n个重复合成一个样本进行SDS-PAGE,一组样本尽量一块凝胶进行分析。 | ##该测定实验本身影响因素较多,所以n个重复合成一个样本进行SDS-PAGE,一组样本尽量一块凝胶进行分析。 | ||
##预实验可省略bca,根据细胞密度简单确定上样体积,使用内参( | ##预实验可省略bca,根据细胞密度简单确定上样体积,使用内参(cell固定表达蛋白,且相对量较为固定)进行相对定量。常用内参: | ||
###GAPDH,参与糖酵解的酶,37 kD | |||
###β-Actin,广泛分布于各种组织中的肌动蛋白,42 kD | |||
#其他: | #其他: | ||
##该实验用于药效评估,药效前应当先做毒性实验 | ##该实验用于药效评估,药效前应当先做毒性实验 | ||
##细胞裂解液的成分:pmsf | ##细胞裂解液的成分:pmsf | ||
## | ##封闭液的组成:BSA或5%脱脂奶粉溶液 | ||
| Line 162: | Line 206: | ||
主要是表面活性剂,破坏生物膜。RIPA含有SDS,脱氧胆酸钠,TritonX-100的混合溶液。 | 主要是表面活性剂,破坏生物膜。RIPA含有SDS,脱氧胆酸钠,TritonX-100的混合溶液。 | ||
<table class="wikitable" style="margin: auto; border-collapse: collapse; border: 1px solid #a2a9b1;"><tr><th>蛋白定位</th><th>裂解液种类</th></tr><tr><td>全细胞</td><td>NP - 40 或 RIPA</td></tr><tr><td>细胞质(可溶性蛋白)</td><td>Tris - HCL</td></tr><tr><td>细胞质(细胞骨架等不溶性蛋白)</td><td>Tris - Triton</td></tr><tr><td>细胞膜</td><td>NP - 40 或 RIPA</td></tr><tr><td>细胞核</td><td>RIPA</td></tr><tr><td>线粒体</td><td>RIPA</td></tr></table> | <table class="wikitable" style="margin: auto; border-collapse: collapse; border: 1px solid #a2a9b1;"><tr><th>蛋白定位</th><th>裂解液种类</th></tr><tr><td>全细胞</td><td>NP - 40 或 RIPA</td></tr><tr><td>细胞质(可溶性蛋白)</td><td>Tris - HCL</td></tr><tr><td>细胞质(细胞骨架等不溶性蛋白)</td><td>Tris - Triton</td></tr><tr><td>细胞膜</td><td>NP - 40 或 RIPA</td></tr><tr><td>细胞核</td><td>RIPA</td></tr><tr><td>线粒体</td><td>RIPA</td></tr></table> | ||
</ol> | </ol> | ||
</div> | </div> | ||
Revision as of 13:24, 7 July 2025
- 前处理-蛋白提取;
- 分离:SDS-PAGE
- 成像:转膜、WB
蛋白提取
- 移液枪转移12孔板中cell培养液到ep管中,底部留存部分液态培养基;
- 胰酶或者细胞刮板分离底部粘璧cell,移液枪转移至上述ep管中。流式不可采用刮板,会损伤cell;刮板用PBS清洗;
- 离心2k rpm 3min,弃去上清,PBS重悬,n合1,再次离心,弃上清,清洗cell
- 配制细胞裂解液:配制100 mM的PMSF in IPA,临用前用商品化的细胞裂解液稀释100倍。
- 按照12孔板每孔cell加入25 ul细胞裂解液的比例向ep管加入cell裂解液,4 ℃裂解10-30min、14k rpm离心15min。(6孔板每孔50ul裂解液)
- 可取部分上清用于BCA测定
- 用上清稀释loading buffer(按照loading buffer 的要求),金属浴or沸水浴 5 - 10min,防止ep管加热过程开盖
- 分装,-40--80℃保存,防止降解
SDS-PAGE
制胶
- 支架下方垫橡胶垫实现密封,薄板朝外装载玻璃板,吸头辅助夹紧

SDS-PAGE制胶装置 - 配制电泳液:每次用量约1.5 L
1.5L SDS-PAGE电泳液组成 Reagent Quantity (for 1.5 L) Tris 4.545 g 甘氨酸 21.6 g SDS 1.5 g UP水 1.5 L - 根据目标蛋白的分子量,按照制胶试剂说明书调配试剂,制作分离胶和浓缩胶,倒入玻璃板,分离胶灌至距绿边1cm,浓缩胶灌满,插入梳子。
SDS-PAGE凝胶比例 - 凝固后,将玻璃板转移至电泳槽中,薄板向里,向夹层中倒入电泳液,验漏(是否夹紧,否则电泳时功率不稳)
- 拔出梳子,吸取电泳液清洗样品孔,排气泡以及排除残余胶液
- 配制Loading buffer上样缓冲液
上样缓冲液组成 Reagent Quantity Tris 3.8 g 10%SDS 10 mL 甘油 10 mL 溴酚蓝 0.05 g UP水 100 mL 巯基乙醇 临用前加入,巯基乙醇:与前述溶液按照=1:3混合 - 上样及marker,一般1孔20ug,最多30ul;最侧边的孔及空余孔上样 1xloading buffer(电泳液稀释)
- 电泳电压:浓缩胶约90V(W约为4W),分离胶约150V(W约为8W),室温
- 溴酚蓝迁移至凝胶2/3处即可停止电泳

SDS-PAGE电泳例图
转膜
- 转膜缓冲液的配制:
1.5L 转膜缓冲液组成 Reagent Quantity (for 1.5 L) Tris 4.545 g 甘氨酸 21.6 g UP水 1.2 L 乙醇 300 mL* *:乙醇待水溶液体系完全溶解后再加入 - PVDF膜及其支撑膜浸入乙醇中活化5 min;转入转膜缓冲液浸泡5 min;膜右上角剪口分辨方向
- 转膜缓冲液倒入盘中,各层预先在盘中浸透
- 黑色在下,按照2层海绵-3层滤纸-gel(切割周围)-3层滤纸-2层海绵,进行叠加,注意排出气泡,夹紧,按照标识放入电泳槽
- 4 ℃冰水浴,300 mAh,电泳约50 min
WB
- 剪裁目标蛋白和参比蛋白的膜,浸入封闭液中,摇床15min(按封闭剂的种类)
- TBST配制:
0.5L TBST缓冲液组成 Reagent Quantity (for 0.5 L) Tris 1.21 g NaCl 4 g UP水* 0.5 L 吐温20** 2.5 mL(0.5%) *:Tris和NaCl溶解后HCl调整pH至7.6(pH计) **:调完pH再加吐温,使用用特殊的枪和吸头 - 弃封闭液,TBST清洗5次(摇床5 min)
- 加一抗5ml(用3%脱脂奶粉稀释),膜浸透,避免漂浮或粘壁,37度摇床1h,4℃过夜
- 回收一抗,膜用TBST清洗5次,每次摇床5min后弃去,去除残余一抗
- 加入二抗(用3%脱脂奶粉稀释),37度摇床1h,TBST清洗5次,最后将膜保存在TBST中
- 使用314的BioRad凝胶成像系统,image lab软件,将缓冲液中保存的膜浸泡至显影液(按说明书配制)中2min,转移至培养皿,放入样品盘,成像
- 仪器:
- 开机:插排-稳压电源-仪器-电脑(关机反方向)
- image lab软件:运行软件-确定-select scanner-chom...-select-chem Hi sentilye(取消VVA勾选)
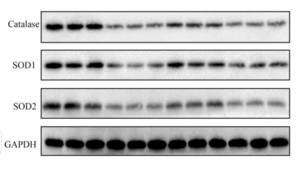
WB结果例图
备注
- 实验操作:
- 制胶前用70%乙醇清洁并擦拭玻璃板,提前洗净烘干。
- 内参一般不和样品同一块膜,单染方便抗体回收,只回收一抗,不回收二抗。一抗多为兔种属,二抗是抗兔的山羊抗,二抗基本只针对一抗的种属。抗体一般-20℃保存。
- 制好的胶尽快使用,不隔夜
- 上层溶液左中右位点均匀加入
- 该测定实验本身影响因素较多,所以n个重复合成一个样本进行SDS-PAGE,一组样本尽量一块凝胶进行分析。
- 预实验可省略bca,根据细胞密度简单确定上样体积,使用内参(cell固定表达蛋白,且相对量较为固定)进行相对定量。常用内参:
- GAPDH,参与糖酵解的酶,37 kD
- β-Actin,广泛分布于各种组织中的肌动蛋白,42 kD
- 其他:
- 该实验用于药效评估,药效前应当先做毒性实验
- 细胞裂解液的成分:pmsf
- 封闭液的组成:BSA或5%脱脂奶粉溶液
原理
- SDS-PAGE原理
阴离子与蛋白质按比例(摩尔比)结合带上负电荷(SDS数量远超蛋白本身电荷数),消除蛋白质原有的电荷差异。SDS破坏蛋白质的氢键、疏水作用力等非共价键,破坏高级结构,解离为蛋白质亚基,蛋白质解聚为单体。(m/z决定电泳结果,即只与蛋白质分子量有关,而与电荷和分子形态无关)。为了确保蛋白质在电泳过程中处于变性展开状态,并且始终带有负电荷,在凝胶蛋白质样品和凝胶缓冲液中,都需要添加SDS。 - SDS-PAGE Loading buffer
主要含有SDS、甘油、β-巯基乙醇(β-ME)、带负电荷的染料(常用溴酚蓝),甘油可以使蛋白样品密度大于电泳缓冲液而沉入梳底。Β-巯基乙醇可以打开二硫键。而带有负电荷的染料,其分子量小于绝大多数的分子样品。迁移速率最快。样品制备好以后,上样之前需要将其加热5分钟,而使其变性展开。 <浓缩胶和> 丙烯酰胺(Arc)和甲叉双丙烯酰胺(Bis,作为聚丙烯酰胺的linker,形成孔洞结构)在催化剂(过硫酸铵,形成自由基)和加速剂(TEMD,二(N-二甲基)乙二胺,加速催化剂形成自由基)的作用下,形成的一种三维网状结构,允许蛋白质通过。可以通过改变丙烯酰胺的浓度来改变孔径的大小。高浓度凝胶孔径小,利于分离小分子蛋白;低浓度的凝胶孔径大,利于分离大分子蛋白。- 电泳缓冲液:pH 8.3,含有SDS、Cl-和甘氨酸(pI 5.97)。
- 上层浓缩胶:pH 6.8,孔径大,样品先进入浓缩胶,形成很窄的条带。因为甘氨酸显示电中性,与负电的Cl-挤压蛋白质,使得条带变窄
- 下层分离胶:pH 8.8,孔径小,通过分子筛分离蛋白质。
- 成像原理
增强化学发光法(ECL):显影剂含有H2O2和鲁米诺(或其衍生物),二抗上的HRP(辣根过氧化物酶)的作用下,发出荧光。稳定性好,灵敏度高,成像性好,对仪器设备无特殊要求,是目前最常用的显影方法。 - 细胞裂解液
主要是表面活性剂,破坏生物膜。RIPA含有SDS,脱氧胆酸钠,TritonX-100的混合溶液。蛋白定位 裂解液种类 全细胞 NP - 40 或 RIPA 细胞质(可溶性蛋白) Tris - HCL 细胞质(细胞骨架等不溶性蛋白) Tris - Triton 细胞膜 NP - 40 或 RIPA 细胞核 RIPA 线粒体 RIPA
- 实验操作: