XIE/Enzyme:2025/Nov: Difference between revisions
| (37 intermediate revisions by the same user not shown) | |||
| Line 40: | Line 40: | ||
== 日期 11.5 == | == 日期 11.5 == | ||
* '''S1-GDH 杂交——超滤与否''' | * '''S1-GDH 杂交——超滤与否''' | ||
#反应1:取 '''30 ul GDH '''溶液,加入 '''PBS 90 ul'''稀释, 取 '''100 ul 加入 1 ul DBCO''' 反应,剩余作为 '''对照 1''' 避光孵育 | #反应1:取 '''30 ul GDH '''溶液,加入 '''PBS 90 ul'''稀释, 取 '''100 ul 加入 1 ul DBCO''' 反应,剩余作为 '''对照 1''' 避光孵育 | ||
| Line 50: | Line 51: | ||
==日期 11.6== | ==日期 11.6== | ||
*'''Native page 验证''' | *'''Native page 验证''' | ||
#配置'''胶液(浓度7.5%-Acr 2 ml)'''、'''1X TEB 1.5 L'''溶液 | #配置'''胶液(浓度7.5%-Acr 2 ml)'''、'''1X TEB 1.5 L'''溶液 | ||
#跑胶 120 V 8 孔'''(对照1、未滤组、超滤组、Marker 、Marker、对照2、中间产物、样品''') | #跑胶 120 V 8 孔'''(对照1、未滤组、超滤组、Marker 、Marker、对照2、中间产物、样品''') | ||
#考马斯亮蓝染色 | #考马斯亮蓝染色 | ||
[[File:25_11_6_GDH_S1.jpg|thumb|center|400X]] | |||
==日期 11.10== | |||
*'''RuCHMO - S2 ''' | |||
#稀释''' RuCHMO ''':取'''RuCHMO'''原液 100 ul,用'''PB Buffer'''稀释至 '''564 ul'''(5 uM),分至 4 管 每管'''140 ul''' | |||
#反应 1:取 1 管 RuCHMO ,吸取 ''''100 ul''' ,加入 '''1 ul DBCO '''溶液.剩余作为空白对照,在'''4℃,冰浴条件下孵育 4 h''' | |||
#超滤 :'''4℃ 12000 转 超滤 20 min ''',清洗并稀释至 '''90 ul''' | |||
#反应 2:向样品溶液中加入 '''10 ul S2''',''' 4℃ 冰浴 过夜''' | |||
==日期 11.11== | |||
*'''Native page 验证''' | |||
#配置'''胶液(浓度7.5%-Acr 2 ml)'''、'''1X TEB 1.5 L'''溶液 | |||
#跑胶 120 V 5 孔'''(Marker、样品、对照1、对照2 、Marker''') | |||
#考马斯亮蓝染色 | |||
[[File:RuCHMO_S2_11_11.jpg|thumb|center|200X|11.11]] | |||
==日期 11.12== | |||
*'''RuCHMO - S2 ''' | |||
#反应 1:取 1 管 RuCHMO ,吸取 ''''100 ul''' ,加入 '''1 ul DBCO '''溶液.剩余作为空白对照,在'''4℃,冰浴条件下孵育 4 h''' | |||
#超滤 :'''4℃ 12000 转 超滤 20 min ''',清洗并稀释至 '''100 ul''',取 30 ul 保留作为 ''' 中间体对照''' | |||
#反应 2:向剩余溶液中加入 '''10 ul S2''',''' 4℃ 冰浴 过夜''' | |||
==日期 11.13== | |||
*'''Native page 验证''' | |||
#配置'''胶液(浓度7.5%-Acr 2 ml)'''、'''1X TEB 1.5 L'''溶液 | |||
#跑胶 120 V 5 孔'''(Marker、对照、样品、中间体 、Marker''') | |||
[[File:RuCHMO_S2_11_13.jpg|thumb|center|300x|11.13]] | |||
== 日期 11.15== | |||
*'''RuCHMO-S2 蛋白条带消失原因''' | |||
#''' 分组 ''' | |||
=== PBS 缓冲组 === | |||
{| class="wikitable" style="text-align:center" | |||
! -80° 保存 !! 常规对照 !! 未超滤组 || 未超滤组 || 超滤组 || 超滤组 | |||
|- | |||
! || || 中间体 || 终产物 || 中间体 || 终产物 | |||
|- | |||
| C1 || C2 || M1 || R1 || M2 || R2 | |||
|} | |||
=== PB 缓冲组 === | |||
{| class="wikitable" style="text-align:center" | |||
! -80° 保存 !! 常规对照 !! 未超滤组 ||未超滤组 || 超滤组 || 超滤组 | |||
|- | |||
! || || 中间体 || 终产物 || 中间体 || 终产物 | |||
|- | |||
| C1' || C2' || M1' || R1' || M2' || R2' | |||
|} | |||
#稀释,采用'''PBS/PB两种buffer'''对照稀释,各保存两管 20 ul -80℃ 冻存 作为对照''' C1 C1'''' | |||
#反应1 各取 200 ul 加入 2 ul DBCO 进行反应,剩余各保留两管 20 ul 4° 冰浴保存作为对照'''C2 C2''''.4°冰浴孵育 4h | |||
#超滤:反应后的溶液,分别一分为二(超滤组、未超滤组),超滤组 4° 12000转 20min | |||
#反应:超滤组将超滤后的溶液一分为二,分别为'''M2 R2'''和'''M2' R2''''(R组加入 5 ul S2 进行反应);未超滤组再一分为二,分别为'''M1 R1'''和'''M1' R1''''(R组加入 5 ul S2进行反应)4°冰浴孵育 4h | |||
=== 凝胶迁移验证 === | |||
*nativepage:浓度 7.5% | |||
*电压:120V | |||
*染色:考马斯亮蓝 | |||
== 11.25 == | |||
=== Staples === | |||
*未修饰 六棱柱(HR)Staples 各取10 ul 混合(500nM) | |||
=== Scaffold=== | |||
*Scaffold 冻干粉末 3 ml UP 水溶解(150nM) | |||
=== Origami 折叠=== | |||
*25 ul Staples + 10 ul Scaffold + 10 ul 10X PBS + 55 ul UP水 | |||
*PCR 程序(80 ℃ 5min , 80 ℃ 逐渐降温至 60 ℃ 20 min , 60 ℃ 缓慢降温至 24℃ 14 h ,4 ℃ 保存) | |||
== 11.26 == | |||
=== 样品纯化 === | |||
*取100 ul 样品中 5 ul作为'''未纯化样品组''',剩余样品置于 100 K超滤管中,加 1X PBS 至500 ul,8000 g 超滤 1.5 min,补足 PBS 至 500 ul,反复纯化3次.纯化结束后,保持体积约为 100 ul 冲洗管壁,倒扣超滤管,离心收集. | |||
=== 琼脂糖凝胶电泳 1 === | |||
[[File:25_11_26_1.png|thumb|center|Unmodified Origami]] | |||
*2 g 琼脂糖加至 100 ml 1X TBE,加热溶解并搅拌至透明,取出放凉至不烫手,再加入 Goldview 10 ul.倒入模具板等待成型 | |||
*上样 6 ul(5+1):Marker、Scaffold、未纯化组、纯化组、Marker. 1X TBE 90 v 90 min | |||
*显影 | |||
=== 琼脂糖凝胶电泳 2 === | |||
[[File:25_11_26_2.png|thumb|center|Scaffold]] | |||
*2.4 g 琼脂糖加至 120 ml 0.5X TBE,加热溶解,0.5X TBE 补足 120 ml,放凉至不烫手,加入 Goldview 12 ul,1.2 ml 1 M MgCl2 ,倒入模具板等待成型 | |||
* 上样 6 ul(5+1):Marker、1X Scaffold、2X Scaffold、1X Scaffold (80℃ 5 min)、2X Scaffold(80℃ 5min)、Marker. 0.5X TBE 90V 120 min | |||
== 11.27 == | |||
===琼脂糖凝胶电泳 === | |||
*制胶 | |||
#配方:2.4 g Agarose; 120 ml 0.5X TBE | |||
#微波炉加热溶解,稍冷,0.5X TBE 补足,加入 1.2 ml 1M MgCl2 和 12 ul Goldview | |||
#插入梳子,待冷却成型 | |||
*制样 | |||
#Origami(15 nM):Louding = 5:1 | |||
#Scaffold: 取1 ul Scaffold 稀释至 10ul(15 nM),Scaffold:Louding = 5:1 | |||
*跑胶:90 V,120 min, 0.5X TBE | |||
[[FIle:25_11_27.png|thumb|center|300px|Ori]] | |||
Latest revision as of 12:35, 30 November 2025
日期 11.3[edit]
1. GDH[edit]
取 GDH 1.4 mg,溶解于 2 mL PBS (1×) 中,形成 20 μM 溶液。 分装于离心管(每管 30 μL,共 4 管),以及 EP 管(400 μL、600 μL、800 μL 各一管)。 取其中 30 ul 管,加入 90 mL PBS (1×, 5 μM)。 取 100 μL 作为待反应液,剩余 20 μL 作为凝胶对照液。
2. DBCO[edit]
称取 DBCO 5 mg,加入 50 μL DMF (100 mM) 溶解。 取 2 μL 稀释至 20 μL (10 mM)。
3. Oligo[edit]
分别向 Seq1、Seq2 中加入UP 水:
- Seq1: 124 μL (1 mM)
- Seq2: 79 μL (1 mM)
各分装离心管 3 支,每支 20 μL。
4.反应[edit]
- 取 DBCO 溶液(10 mM) 1 ul 加入待反应溶液,室温下,抽屉内避光孵育 5 h
- 反应后的溶液,超滤离心 2000 转 3 min 25 ℃ , 吸取离心后上清液并稀释至 90 ul ,二次清洗液 90 ul
- 加入 Seq1 (1 mM) 10 ul 于上清液中,抽屉中孵育过夜
日期 11.4[edit]

1. nativepage[edit]
- 制胶:配置胶液(浓度9%) 1 X TBE 溶液
- 上样:上样前 吹去孔中杂质,上样 7 孔(Marker、纯蛋白液、样品液、超滤洗液、Marker 、蛋白缓冲、蛋白缓冲)
- 跑胶:120 V
2. 考马斯亮蓝染色[edit]
- 切取胶体,于培养皿中注入 10 ml 考马斯亮蓝 ,37 ℃ 摇床振摇 3 h
- 吸出培养皿中的考马斯亮蓝溶液,置于 15 ml 离心管 4°存储备用;用 UP 水反复清洗胶体基底至原色。
总结 1. 超滤时间过短,未有滤液 2. TBE 溶液 未调 PH 3. 用枪混乱,量不准
日期 11.5[edit]
- S1-GDH 杂交——超滤与否
- 反应1:取 30 ul GDH 溶液,加入 PBS 90 ul稀释, 取 100 ul 加入 1 ul DBCO 反应,剩余作为 对照 1 避光孵育
- 将样品平均分为两份(超滤组、未滤组),超滤组 12000 转 20 min
- 反应2:分别向以上两组样品中各加入 5 ul S1 避光孵育过夜
- S1-GDH 杂交——中间体验证
- 反应1:取 30 ul GDH 溶液,加入 PBS 90 ul稀释, 取 100 ul 加入 1 ul DBCO 反应,剩余作为 对照 2' 避光孵育4 h
- 中产物:,样品 12000 转 20 min 超滤 ,保留样品 20 ul作为 中间产物对照
- 反应2:吸出超滤液,少量多次清洗滤管,收集清洗液并保持体积为 80 ul ,加入 S1 8 ul 孵育过夜
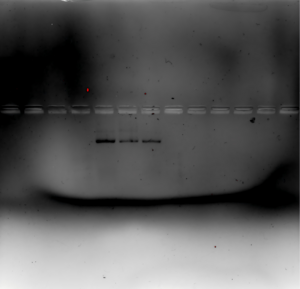
日期 11.6[edit]
- Native page 验证
- 配置胶液(浓度7.5%-Acr 2 ml)、1X TEB 1.5 L溶液
- 跑胶 120 V 8 孔(对照1、未滤组、超滤组、Marker 、Marker、对照2、中间产物、样品)
- 考马斯亮蓝染色
日期 11.10[edit]
- RuCHMO - S2
- 稀释 RuCHMO :取RuCHMO原液 100 ul,用PB Buffer稀释至 564 ul(5 uM),分至 4 管 每管140 ul
- 反应 1:取 1 管 RuCHMO ,吸取 '100 ul ,加入 1 ul DBCO 溶液.剩余作为空白对照,在4℃,冰浴条件下孵育 4 h
- 超滤 :4℃ 12000 转 超滤 20 min ,清洗并稀释至 90 ul
- 反应 2:向样品溶液中加入 10 ul S2, 4℃ 冰浴 过夜
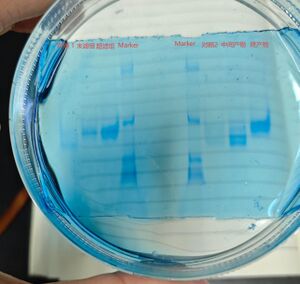
日期 11.11[edit]
- Native page 验证
- 配置胶液(浓度7.5%-Acr 2 ml)、1X TEB 1.5 L溶液
- 跑胶 120 V 5 孔(Marker、样品、对照1、对照2 、Marker)
- 考马斯亮蓝染色
日期 11.12[edit]
- RuCHMO - S2
- 反应 1:取 1 管 RuCHMO ,吸取 '100 ul ,加入 1 ul DBCO 溶液.剩余作为空白对照,在4℃,冰浴条件下孵育 4 h
- 超滤 :4℃ 12000 转 超滤 20 min ,清洗并稀释至 100 ul,取 30 ul 保留作为 中间体对照
- 反应 2:向剩余溶液中加入 10 ul S2, 4℃ 冰浴 过夜
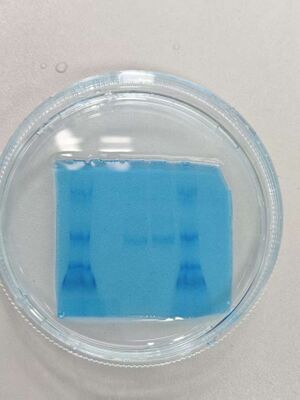
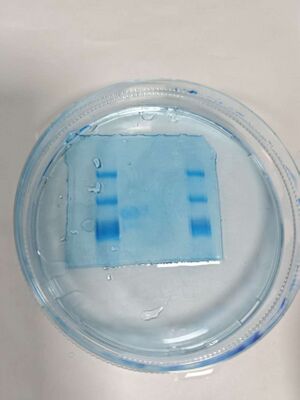
日期 11.13[edit]
- Native page 验证
- 配置胶液(浓度7.5%-Acr 2 ml)、1X TEB 1.5 L溶液
- 跑胶 120 V 5 孔(Marker、对照、样品、中间体 、Marker)
日期 11.15[edit]
- RuCHMO-S2 蛋白条带消失原因
- 分组
PBS 缓冲组[edit]
| -80° 保存 | 常规对照 | 未超滤组 | 未超滤组 | 超滤组 | 超滤组 |
|---|---|---|---|---|---|
| 中间体 | 终产物 | 中间体 | 终产物 | ||
| C1 | C2 | M1 | R1 | M2 | R2 |
PB 缓冲组[edit]
| -80° 保存 | 常规对照 | 未超滤组 | 未超滤组 | 超滤组 | 超滤组 |
|---|---|---|---|---|---|
| 中间体 | 终产物 | 中间体 | 终产物 | ||
| C1' | C2' | M1' | R1' | M2' | R2' |
- 稀释,采用PBS/PB两种buffer对照稀释,各保存两管 20 ul -80℃ 冻存 作为对照 C1 C1'
- 反应1 各取 200 ul 加入 2 ul DBCO 进行反应,剩余各保留两管 20 ul 4° 冰浴保存作为对照C2 C2'.4°冰浴孵育 4h
- 超滤:反应后的溶液,分别一分为二(超滤组、未超滤组),超滤组 4° 12000转 20min
- 反应:超滤组将超滤后的溶液一分为二,分别为M2 R2和M2' R2'(R组加入 5 ul S2 进行反应);未超滤组再一分为二,分别为M1 R1和M1' R1'(R组加入 5 ul S2进行反应)4°冰浴孵育 4h
凝胶迁移验证[edit]
- nativepage:浓度 7.5%
- 电压:120V
- 染色:考马斯亮蓝
11.25[edit]
Staples[edit]
- 未修饰 六棱柱(HR)Staples 各取10 ul 混合(500nM)
Scaffold[edit]
- Scaffold 冻干粉末 3 ml UP 水溶解(150nM)
Origami 折叠[edit]
- 25 ul Staples + 10 ul Scaffold + 10 ul 10X PBS + 55 ul UP水
- PCR 程序(80 ℃ 5min , 80 ℃ 逐渐降温至 60 ℃ 20 min , 60 ℃ 缓慢降温至 24℃ 14 h ,4 ℃ 保存)
11.26[edit]
样品纯化[edit]
- 取100 ul 样品中 5 ul作为未纯化样品组,剩余样品置于 100 K超滤管中,加 1X PBS 至500 ul,8000 g 超滤 1.5 min,补足 PBS 至 500 ul,反复纯化3次.纯化结束后,保持体积约为 100 ul 冲洗管壁,倒扣超滤管,离心收集.
琼脂糖凝胶电泳 1[edit]
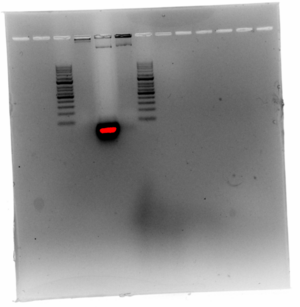
- 2 g 琼脂糖加至 100 ml 1X TBE,加热溶解并搅拌至透明,取出放凉至不烫手,再加入 Goldview 10 ul.倒入模具板等待成型
- 上样 6 ul(5+1):Marker、Scaffold、未纯化组、纯化组、Marker. 1X TBE 90 v 90 min
- 显影
琼脂糖凝胶电泳 2[edit]
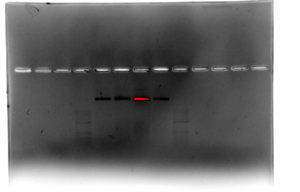
- 2.4 g 琼脂糖加至 120 ml 0.5X TBE,加热溶解,0.5X TBE 补足 120 ml,放凉至不烫手,加入 Goldview 12 ul,1.2 ml 1 M MgCl2 ,倒入模具板等待成型
- 上样 6 ul(5+1):Marker、1X Scaffold、2X Scaffold、1X Scaffold (80℃ 5 min)、2X Scaffold(80℃ 5min)、Marker. 0.5X TBE 90V 120 min
11.27[edit]
琼脂糖凝胶电泳[edit]
- 制胶
- 配方:2.4 g Agarose; 120 ml 0.5X TBE
- 微波炉加热溶解,稍冷,0.5X TBE 补足,加入 1.2 ml 1M MgCl2 和 12 ul Goldview
- 插入梳子,待冷却成型
- 制样
- Origami(15 nM):Louding = 5:1
- Scaffold: 取1 ul Scaffold 稀释至 10ul(15 nM),Scaffold:Louding = 5:1
- 跑胶:90 V,120 min, 0.5X TBE